公司电话:0769-85602287 投诉建议:150-1483-7000 邮箱:yinso2@163.com 地址:东莞市大岭山镇梅林路59号
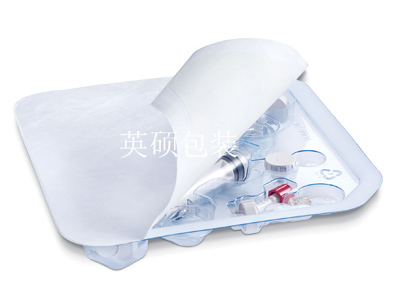
英硕包装对于医疗器械包装材料的生物相容性和毒理学性能的一些看法
来源:英硕包装 发布时间:2018-04-19 点击量:2194
用国际标准化组织ISO会议的解释,关于医疗器械或者材料和人体的接触,其生物反应的评估可能包括细胞毒性、致敏、刺激或皮内反应、全身毒性、亚慢性毒性、基因毒性、植入、血液相容性等。而毒理学性能其实就是指材料会有不会携带有毒物质以及本身会不会产生有毒物质。
ISO10993对于医疗器械包装材料的生物相容性和毒理学性能的验证有16个标准,内容可以说是非常多了,其中第7部分:环氧乙烷灭菌残留量和第10部分:刺激与持续型过敏试验是FDA的要求。虽然欧洲根据纸张的特性一般规定了几项化学检测,例如:五氯苯酚、多氯联苯、甲醛、纸张杀菌剂的迁移等,这些将问题简化,使操作性更强了。但是英硕包装认为,我们的医疗器械包装材料是不直接接触人体的,所以只要符合直接接触性食品包装材料的要求就可以了,除非说是由其他特殊的用途。而且,根据英硕包装收到的一些国外客户给出的要求来看,他们的要求其实并不高于我国食品包装纸(GB1014-1991)的要求,只是说他们更加专业一些而已。
你可能会对这篇文章感兴趣:重视医疗器械包装以降低手术感染风险
相关产品
热点资讯
- 英硕医用包装|新春开工启新程,安全护航再出发!2025-02-06
- 【英硕包装】2025 年春节放假通知2025-02-06
- 不同维度来了解医用吸塑盒与普通吸塑盒的差别2022-02-17
- 影响灭菌医疗器械包装环氧乙烷灭菌效果的因素2021-10-30
- 最终灭菌医疗器械包装常用系列标准参考2021-08-02
- 医用硬质吸塑盒的材质选择简述2021-07-20
- 无菌包装材料的评估项目及测试方法参考2021-07-17
- 影响医疗器械货架有效期的因素2021-07-17